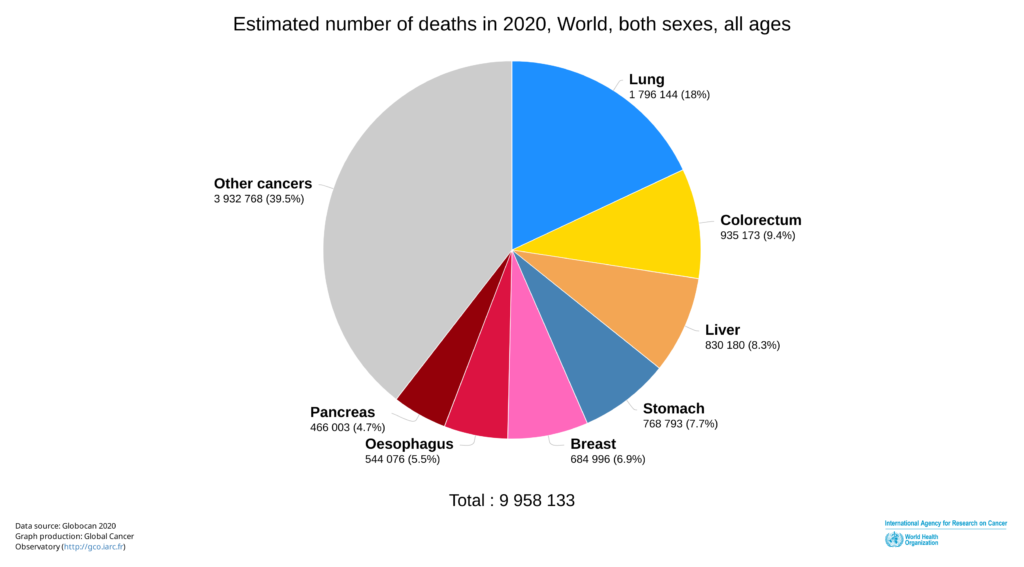
| Ung thư đại trực tràng:
> Năm 2020, có 16.000 ca mắc mới tại Việt Nam (Theo GLOBOCAN) > Gây tử vong thứ 2 trên thế giới. > 90% được điều trị khỏi nếu phát hiện sớm [2]. > Phát hiện sớm hỗ trợ điều trị hiệu quả [3]. |
Ung thư đại trực tràng
Đại trực tràng là phần cuối của hệ tiêu hóa. Thành của nó được cấu tạo nhiều lớp. Lớp trong cùng, tiếp xúc trực tiếp với phân là niêm mạc, nơi các tế bào ung thư xuất hiện sớm nhất.
> Những khối tế bào phát triển bất thường thường xuất hiện tại lớp niêm mạc gọi là các polyp. Mặc dù hầu hết các polyp không trở thành ung thư, tuy nhiên sẽ có một số polyp sẽ có nguy cơ tiến triển thành ung thư đại trực tràng. [1]
>> Các tế bào u này thường được tìm thấy rất sớm trong mẫu phân.
>>> Vì vậy, xét nghiệm phân là một trong những phương pháp phát hiện sớm nhất ung thư đại trực tràng.
Methyl hóa gen và sàng lọc ung thư đại trực tràng
Quá trình methyl hóa DNA được xem là cơ chế chính dẫn tới sự bất thường trong hoạt động của các gen liên quan đến quá trình hình thành ung thư, đặc biệt là ở các gen có vai trò ức chế khối u [4].
Các nghiên cứu đã chỉ ra rằng có sự khác biệt rõ rệt giữa mức độ methylhóa gen, SEPT9 và TFPI-2 ở tế bào ung thư đại trực tràng và ở các tế bào khỏe mạnh, vì thế đây được xem là các dấu ấn phổ biến được sử dụng trong sàng lọc ung thư đại trực tràng với độ nhạy và độ đặc hiệu lên tới 95% [5].
Việc sàng lọc và phát hiện ung thư đại trực tràng ở giai đoạn sớm sẽ đóng vai trò quyết định trong quá trình điều trị bệnh [6] [7].
Xét nghiệm sự methyl hóa DNA được thực hiện trên DNA được tách chiết trong phân của bệnh nhân (stool DNA test):
|
 |
————————————————————————————-
SEPT9
– SEPT9: gen ức chế khối u nhờ điều hòa phân bào.
– Methyl hóa bất thường ở SEPT9 gây rối loạn chức năng ức chế u.
– Xét nghiệm methyl hóa SEPT9 được FDA cấp phép và công nhận trong quá trình sàng lọc sớm ung thư đại trực tràng [8].
————————————————————————————-
TFPI-2
– TFPI-2 là một gen ức chế khối u, có vai trò trong tổng hợp Tissue Factor Pathway Inhibitor-2.
– TFPI-2 ức chế sự xâm lấn, phát triển cũng như sự di căn của khối u.
– Methyl hóa bất thường của TFPI-2 là cơ sở để phát triển, xâm lấn và di căn u.
————————————————————————————-
Đối tượng nên thực hiện xét nghiệm
Nhóm người có các biểu hiện về vấn đề đường tiêu hóa gây ra
- Rối loạn đại tiện như tiêu chảy, táo bón, phân sống.
- Đại tiện ra máu, đại tiện màu đen.
- Có cảm giác buồn đi ngoài thường xuyên nhưng đi ngoài không hết phân.
- Đau bụng thường xuyên.
- Mệt mỏi, thiếu máu.
- Sút cân không rõ nguyên nhân.
Nhóm nguy cơ tăng
- Gia đình có tiền sử ung thư đại trực tràng.
- Bản thân có polyp trực tràng có nguy cơ ung thư.
- Tiền sử các bệnh viêm loét đại trực tràng và bệnh viêm đại tràng Crohn.
Nhóm nguy cơ cao bệnh nhân hội chứng ung thư di truyền
- Hội chứng Lynch.
- Hội chứng đa polyp (chẳng hạn như đa polyp tuyến gia đình cổ điển và suy yếu).

Thu mẫu, phân tích và trả kết quả
Mẫu bệnh phẩm: 5ml phân được đựng trong ống lưu trữ chuyên dụng.
Bảo quản mẫu: Khuyến cáo thực hiện xét nghiệm càng sớm càng tốt sau khi nhận mẫu.
- Mẫu phân: bảo quản 7 ngày ở nhiệt độ phòng hoặc 6 tháng ở -30 đến -15°C.
- Mẫu DNA tách chiết: bảo quản 6 tháng ở -30 đến -15°C.
Mẫu được phân tích trực tiếp tại trung tâm xét nghiệm Genome.
Nguyên lý hoạt động: Genome sử dụng kỹ thuật sinh học phân tử đánh giá sự methyl hóa quá mức của gen SEPT9 và IFPI2 nhằm phát hiện sớm ung thư đại trực tràng.
Bệnh nhân có kết quả nguy cơ cao với ung thư đại trực tràng được khuyến cáo thực hiện nội soi đại tràng và sinh thiết chẩn đoán.

Ban cố vấn chuyên môn
 |

|
 |
 |
Tài liệu tham khảo
[1] Provenzale, D.et al , “NCCN Guidelines Insights: Colorectal Cancer Screening, Version 2.2020,” Journal of the National Comprehensive Cancer Network J Natl Compr Canc Netw, 18(10), pp. 1312-1320, Retrieved Jul 24, 2023.
[2] F. e. a. Bray, “Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries,” CA Cancer, p. 394–424, 2018.
[3] E. L. &. S. Y. Greer, “Histone methylation: a dynamic mark in health, disease and inheritance,” . Nat. Rev.Genet., pp. 343-357, 2012.
[4] Goel, A. & Boland, C. R, “Epigenetics of colorectal cancer,” Gastroenterology, pp. 1442-1460, 2012.
[5] T. Oh, “Genome-Wide Identification and Validation of a Novel Methylation Biomarker, SDC2, for Blood-Based Detection of Colorectal Cancer,” The journal of Molecular Diagnostics, pp. 498-507, 2013.
[6] J. &. Y. J. Ng, “Promoter hypermethylation of tumour suppressor genes as potential biomarkers in colorectal cancer,” Int. J. Mol. Sci, p. 2472–2496, 2015.
[7] T. e. a. Huang, “Targeting histone methylation for colorectal cancer,” Therap. Adv. Gastroenterol, p. 114–131, 2017.
[8] L. J. J. P. X. X. W. &. L. Y. Song, “The performance of the SEPT9 gene methylation assayand a comparison with other CRC screening tests: a meta-analysis,” Scientific report, pp. 1-12, 2017.
[9] S. C. e. a. Glöckner, “Methylation of TFPI2 in stool DNA: a potential novel biomarker for the detection of colorectal cancer,” Cancer Res, pp. 4691-4699, 2009.
[10] B. K. e. a. . Barták, “Colorectal adenoma and cancer detection based on altered methylation pattern of SFRP1, SFRP2, SDC2, and PRIMA1 in plasma samples,” Epigenetics, pp. 495-501, 2017.
